Leistungsangebot der Diagnoselabore – Untersuchungen auf Schaderreger
 Zoombild vorhanden
Zoombild vorhanden
Ausstanzen von Blattscheibchen für die Virusuntersuchung
Die Diagnoselabore der LfL untersuchen Pflanzen auf Schadorganismen. Die eingereichten Proben stammen von Pflanzenbauberatern, Ämtern, Erzeugerringen, Landwirten, Gartenbauern, Universitäten, Hochschulen und anderen Einrichtungen. Für den Hoheitsvollzug testen wir Pflanzen auf Quarantäneschaderreger und Schadorganismen, die aufgrund pflanzengesundheitlicher Vorschriften überwacht werden müssen. Und wir arbeiten auch mit in Forschungsprojekten zur Schaderregerbekämpfung. Auch Privatpersonen können Proben an uns einsenden. Primär sind wir für zuständig für in Bayern ansässige Auftraggeber. Alle anderen bitten wir, sich an das Labor des Pflanzenschutzdienstes des jeweiligen Bundeslandes zu wenden. Die Untersuchungen sind sehr aufwändig und erfordern zum Teil mehrstufige Analysen mit verschiedensten Methoden. Wir möchten darauf hinweisen, dass wir diese Untersuchungen nicht kostenfrei anbieten können und bitten um Ihr Verständnis.
Warum ist Diagnose so wichtig?
 Zoombild vorhanden
Zoombild vorhanden
Fluoreszenzkurven der Realtime PCR
Wichtig zu wissen
Probeneinsendung
Untersuchung auf Pilze:
Dr. Peter Büttner
LfL, IPS 2a - Mykologie
Lange Point 10
85354 Freising
Tel.: 08161 8640-5680
Fax: 08161 8640-5555
E-Mail: mykologie@LfL.bayern.de
Untersuchung auf Bakterien:
Dr. Jan Nechwatal
LfL, IPS 2b - Bakteriologie
Lange Point 10
85354 Freising
Tel.: 08161 8640-5677
Fax: 08161 8640-5555
E-Mail: phytobakteriologie@LfL.bayern.de
Untersuchung auf Viren:
Dr. Veronika Wetzel
LfL, IPS 2c - Virologie
Lange Point 10
85354 Freising
Tel.: 08161 8640-5695
Fax: 08161 8640-5555
E-Mail: virologie@LfL.bayern.de
Untersuchung auf tierische Schaderreger (außer Nematoden):
Dr. Ullrich Benker
LfL, IPS 2d - Zoologie, Vorratsschutz
Lange Point 10
85354 Freising
Tel.: 08161 8640-5720
Fax: 08161 8640-5555
E-Mail: zoologie@LfL.bayern.de
Untersuchung auf Nematoden
Andreas Hermann
LfL, IPS 2d - Zoologie, Vorratsschutz
Lange Point 10
85354 Freising
Tel.: 08161 8640-5722
Fax: 08161 8640-5555
E-Mail: nematologie@LfL.bayern.de
Probenahme
Die Probenahme hat Einfluss auf das Testergebnis
Bitte beachten Sie
- Eine korrekte Probenahme, auch Termin und welche Pflanzenteile beprobt werden sowie der schnelle Transport sind mit entscheidend für ein korrektes Ergebnis. Probenahme und Einsendung sind deshalb sorgfältig zu planen und durchführen. Da wir keinen Einfluss auf die Probennahme haben, liegt die Probenahme in der Verantwortung des Einsenders.
- Ein Erreger ist meist nicht gleichmäßig in der Pflanze verteilt. Die Verteilung und auch die Konzentration eines Erregers in der Pflanze werden von einer Vielzahl an Einflussfaktoren bestimmt, z.B. von der Biologie des Erregers, der Jahreszeit, den Kulturbedingungen, der Kultur und der Sorte.
- Zu bedenken ist auch, dass bei der Probenahme und beim Versand Erreger verschleppt werden können; achten Sie also darauf, dass es bei Probenahme und Verpackung nicht zu einer gegenseitigen Kontamination (Verunreinigung) der Proben kommt (also z.B. Hände nach jeder Probe so gut wie möglich reinigen, ggf. Einmalhandschuhe benutzen, Werkzeuge wechseln, Proben einzeln verpacken)
- Wichtig ist auch der schnelle Transport der Probe in das Diagnoselabor. Senden Sie deshalb bitte Proben nicht am Wochenende, sondern am Wochenanfang an uns. Beachten Sie Feiertage. Und informieren Sie uns vorab, damit wir bei einer Probe, die nicht oder nicht rechtzeitig bei uns angekommen ist, Kontakt mit Ihnen aufnehmen können.
Bearbeitungsdauer
Informationen zu Untersuchungen in der Virologie: Methoden und Gebühren
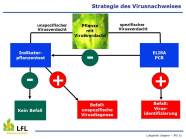 Zoombild vorhanden
Zoombild vorhanden
Strategie des Virusnachweises an der LfL
Qualitätsmanagement
Methoden bei der Virusdiagnose
ELISA (Enzyme linked immuno-sorbent assay)
- Der ELISA ist ein spezifisches immunologisches Verfahren: Gezielte Untersuchung auf ein bestimmtes Virus oder bestimmte Viren (Virusscreening), die bei der Wirtspflanze häufig vorkommen und/oder bei vorliegender Symptomatik als Schadursache in Frage kommen. Gezielt werden charakteristische Eiweiße (Proteine) des Erregers nachgewiesen. Dabei werden Virus-spezifische Antiseren (Antikörper) eingesetzt.
- Nur diejenigen Viren werden erfasst, auf die getestet wird; ein negativer Befund schließt das Vorliegen anderer Viren oder anderer Schaderreger nicht aus.
- Nahe verwandet Viren können unter Umständen nicht voneinander unterschieden werden.
- Es kann sein, dass bestimmte Virusstämme vom eingesetzten Antiserum nicht erkannt werden; dies kann zu einem falsch negativen Ergebnis führen.
- Das Ergebnis liegt in der Regel ca. 1-2 Wochen nach Probeneingang vor.
PCR-basierte Verfahren
- Folgende PCR-basierte Verfahren kommen zum Einsatz:
- Polymerase chain reaction (PCR, Polymerase-Kettenreaktion) und Realtime PCR (qPCR) : für den Nachweis von Phytoplasmen
- Reverse transcriptase polymerase chain reaction (RT-PCR), Realtime RT-PCR (qRT-PCR): für den Nachweis von Viren und Viroiden
- PCR-basierte Verfahren sind spezifische molekularbiologische Verfahren: Gezielte Untersuchung auf bestimmte Viren, Viroide bzw. Phytoplasmen, die bei vorliegender Wirtspflanze häufig vorkommen und/oder bei vorliegender Symptomatik Schadursache sein könnten. Dabei wird aus dem Pflanzenmaterial mitsamt den enthaltenen Schaderregern das Erbmaterial (DNA oder RNA) extrahiert. Ein bestimmter Bereich des Erbmaterials des jeweiligen Erregers wird dann in der PCR gezielt vermehrt und kann dann nachgewiesen werden. Dabei kommen Virus-, Viroid- bzw. Phytoplasma-spezifische Primer und bei der Realtime PCR/RT-PCR zusätzlich spezifische Gensonden zum Einsatz. In bestimmten Fällen ist eine weitere Bestätigung des Ergebnisses und eine Erregeridentifizierung mittels Sequenzierung der PCR-Produkte (Bestimmung der genetischen Sequenz) notwendig. Für die Sequenzierung werden die PCR-Produkte an ein externes Labor geschickt, das sich als zuverlässig erwiesen hat.
- Nur diejenigen Viren/Viroide/Phytplasmen werden erfasst, auf die getestet wird; ein negativer Befund schließt das Vorliegen anderer Viren/Viroide/Phytoplasmen nicht aus.
- Trotz hoher Spezifität des Nachweises können eng miteinander verwandte Viren unter Umständen nicht sicher zu unterschieden werden. Bei Bedarf ist über die Sequenzierung der PCR-Produkte, die in einem externen Labor durchgeführt, meist eine Abklärung möglich.
- Es kann sein, dass bestimmte Virus-/Viroidstämme von den eingesetzten Primern und der verwendeten Gensonde nicht erkannt werden; dies gilt insbesondere für neu auftretende Virus-/Viroidstämme. Dies kann zu einem falsch negativen Ergebnis führen.
- Mit PCR-basierten Verfahren werden auch nicht (mehr) infektiöse Viren, Viroide bzw. Phytoplasmen nachgewiesen; ein positives Ergebnis beweist also nicht die Infektiosität des Erregers.
Indikatorpflanzentest an krautigen Testpflanzen
- Der Indikatorpflanzentest ist ein unspezifisches biologisches Verfahren, bei dem die Infektiosität des Virus untersucht wird.
- Es werden nur mechanisch übertragbare Viren erfasst.
- Viren werden nur dann nachgewiesen, wenn sie noch infektiös sind.
- Bei bestimmten Pflanzen (z.B. holzigen Pflanzen oder Pflanzen mit phenolischen Inhaltstoffen) funktioniert der Test nicht oder nicht zuverlässig.
- Manche Viren werden mit dem verwendeten Testpflanzenspektrum (Nicotiana tabacum „Samsun“, N. rustica, N. benthamiana, N. clevelandii, Chenopodium quinoa) nicht nachgewiesen.
- Der Test kann als erster Test erfolgen, wird in der Regel aber bei negativem ELISA- bzw. negativem RT-PCR/PCR-Befund als sich anschließender Test durchgeführt. Der Indikatorpflanzentest kann auch nach Absprache durchgeführt werden.
- Der Test dauert ca. weitere 4 Wochen.
Gebühren für Untersuchungen in der Virologie
Die Gebühren werden abhängig von der zu untersuchenden Pflanze entsprechend dem jeweiligen Untersuchungsaufwand erhoben. Die Gebühren werden für jede Probe erhoben.Bitte fragen Sie ggf. bei uns nach.
- ELISA: Erste Probe bzw. erster Test (erstes Virus): 22,50 Euro, jede weitere Probe bzw. jeder weitere Test (jedes weitere Virus): 6,00 €. Bei hohem Untersuchungsgaufwand sind die Kosten höher.
- ELISA Virusscreening (Test auf mehrere Viren): Der Preis ist abhängig von der zu untersuchenden Kultur, vom nachzuweisenden Erregerspektrum und dem jeweiligen Untersuchungsaufwand: mindestens werden 36,50 Euro in Rechnung gestellt z. B. bei Cucurbitaceen (Gurke, Kürbis etc.), bei Solanaceen werden 52,00 Euro berechnet. Die Kosten können auch höher sein.
- PCR-Untersuchungen: Der Preis ist abhängig von der zu untersuchenden Kultur, vom nachzuweisenden Erreger und dem jeweiligen Untersuchungsaufwand. In der Regel werden für die erste Probe 50 Euro in Rechnung gestellt und für jede weitere 25 Euro. In Abhängigkeit vom Untersuchungsaufwand können die Kosten aber auch höher sein. Eventuell notwendige Sequenzierungen, die von uns zur Ergebnisbestätigung und Erregeridentifizierung in einem externen Labor beauftragt werden, werden zusätzlich in Rechnung gestellt.
- Indikatorpflanzentest: 88,50 € je Probe
Informationen zu Untersuchungen in der Bakteriologie: Methoden und Gebühren
Qualitätsmanagement
Vorgehensweise bei der Diagnose von Bakterienkrankheiten
Bei unseren Labormethoden unterscheiden wir grob zwei Bereiche:
- Nachweis = reiner Nachweis der An- oder Abwesenheit eines Krankheitserregers in der Pflanze. Dies kann über molekulargenetische (Polymerase-Kettenreaktion, PCR) oder serologische (z.B. Immunfluoreszenz-Test, Streifen-Schnelltest) Verfahren erfolgen. Ist nicht zwangsläufig mit einer Anzüchtung von Bakterien verbunden (kulturunabhängig).
- Isolierung und Identifizierung = Ausbringen des Pflanzenextraktes auf feste Nährmedien, Isolierung und Anzüchtung einzelner verdächtiger Erregerkolonien und anschließende Identifizierung dieser Isolate. Die Identifizierung erfolgt über klassische biochemische Tests oder serologische und molekulare Methoden.
- Fällt ein Nachweistest negativ aus, kann i.d.R. davon ausgegangen werden, dass der Erreger nicht vorhanden ist. Es müssen keine Kolonien weiter untersucht bzw. identifiziert werden.
- Fällt er positiv aus, wird versucht, den Erreger in Kultur zu nehmen. Verdächtige Kolonien werden mit unterschiedlichen Methoden identifiziert, bis schließlich im Idealfall eine Reinkultur eines pathogenen Bakteriums vorliegt.
Je nach angewandtem Methodenspektrum liegt das Ergebnis einer bakteriologischen Laboruntersuchung nach 1 bis maximal 3 Wochen vor.
Methoden bei der Diagnose von Bakterienkrankheiten
Klassische mikrobiologische Verfahren
- Plattieren, Isolieren: klassisches, kulturbasiertes bakteriologisches Verfahren, bei dem das gewonnene Pflanzenextrakt in verschiedenen Verdünnungen auf geeignete Nährmedien (Agarplatten) ausgebracht wird. Die dort aufwachsenden Bakterienkulturen werden nach Farbe, Form und Beschaffenheit etc. ausgelesen, vereinzelt und in Reinkultur gebracht (isoliert).
- Identifizierung mit biochemischen Tests: die in Reinkultur vorliegenden Bakterienisolate werden mittels biochemischer Tests identifiziert, d.h. es wird gezeigt, zu welcher Art sie genau gehören. Diese Tests prüfen wichtige Stoffwechselleistungen einer Bakterienart bzw. grundlegende Virulenz-Eigenschaften.
Serologische Verfahren
- IF-Test (Immunfluoreszenz-Test): die im Pflanzenextrakt oder in Reinkultur vorliegenden Bakterien lassen sich mithilfe von spezifischen Antikörpern und daran gekoppelten Fluoreszenzfarbstoffen anhand ihrer Eiweißbestandteile am Mikroskop sichtbar machen (IF-Test, wird nur noch selten durchgeführt).
- Schnelltests (Streifentests): mithilfe kommerzieller Schnelltests lassen sich bestimmte Erreger (z.B. Feuerbrand, Erwinia amylovora) anhand ihrer Eiweißbestandteile schnell und sicher direkt im Pflanzenextrakt nachweisen bzw. als Reinkultur identifizieren.
- Agglutinationstests: die in Reinkultur vorliegenden Bakterienisolate werden mit einem geeigneten, spezifischen Antikörper zusammengebracht. Wenn der gesuchte Erreger vorliegt, kommt es zu einer erkennbaren Eiweiß-Ausflockung.
Molekulargenetische Verfahren
- PCR (Polymerase-Kettenreaktion): aus dem gewonnenen Pflanzenextrakt bzw. einer Bakterien-Reinkultur wird die gesamte DNA (Erbsubstanz) extrahiert und mittels PCR weiter untersucht. Die PCR vervielfältigt spezifisch nur DNA-Abschnitte des gesuchten Erregers und kann diese „sichtbar“ machen. Für eine immer größer werdende Zahl bakterieller Erreger stehen PCR-Systeme zur Verfügung, die einen zuverlässigen und empfindlichen Nachweis bzw. die Identifizierung eines Pathogens ermöglichen. Besonders geeignet ist das Verfahren als erster Screening-Test, der zeigt, ob eine Probe weiter untersucht werden soll.
Bestätigungstests (nur in Ausnahmefällen nach Absprache mit dem Kunden)
- Pathogenitätstest: hier werden Testpflanzen künstlich mit dem isolierten Erreger infiziert. Dies kann eine endgültige Bestätigung für die Virulenz eines isolierten/identifizierten Erregers liefern. Bei manchen Quarantäne-Schaderregern ist dies vorgeschrieben.
- Sequenzierung: hierbei wird die exakte DNA-Sequenz eines geeigneten Bereiches der Erbsubstanz ausgelesen und zur Bestätigung der Identifizierung verwendet. Oft sind Sequenzierungen der einzige Weg, bestimmte Erreger bzw. deren taxonomische Stellung sicher nachzuweisen bzw. zu identifizieren, z.B. bei Xylella fastidiosa. Sofern DNA-Sequenzierungen für eine sinnvolle Auswertung von molekularen (PCR-) Ergebnissen notwendig und angezeigt sind, werden sie nicht separat in Rechnung gestellt. Sequenzierungen werden durch ein beauftragtes Labor, das für dieses Verfahren nach ISO 17025 akkreditiert ist, extern durchgeführt.
Gebühren für Untersuchungen in der Bakteriologie
Die Gebühren werden je Probe erhoben
- Probenaufbereitung + Isolierung (keine verdächtigen Bakterienkolonien, kein Wachstum): 20,- Euro
- Probenaufbereitung + Nachweis + Isolierung + Identifizierung: 80,- Euro
- Probenaufbereitung + Nachweis + Isolierung (Nachweis negativ, keine verdächtigen Kolonien oder kein Wachstum): erste Probe 70,- Euro, jede weitere Probe 56,- Euro
- Probenaufbereitung + Nachweis (nur PCR-screening): erste Probe 62,- Euro, jede weitere Probe 46,50 Euro
- Probenaufbereitung + Nachweis + Isolierung + Identifizierung + Bestätigungstest: 158,- Euro (nur nach zusätzlicher Absprache mit dem Kunden)
Informationen zu Untersuchungen in der Mykologie: Methoden und Gebühren
Wissenswertes zur Diagnose von Pilzkrankheiten
Qualitätsmanagement
Vorgehensweise zur Diagnose von Pilzkrankheiten
Wir bieten hier folgende Untersuchungen an:
- Besatz von Weizen- und Dinkelsaatgut mit Sporen des Stein- und Zwergsteinbrandes mittels eines Filtrationsverfahrens
- Befall von Gerstensaatgut mit Flugbrand – Analyse von 2000 Embryonen je Probe
- Brennflecken bei Erbse (Ascochyta pisi u.a.)
- Brennflecken bei Lupine (Agarplattentest)
- Brennflecken und Schokoladenflecken bei Ackerbohnen (Agarplattentest)
- Phomopsis-Komplex (Diaporthe phaseolorum) bei Sojabohnen (Agarplattentest)
- Botrytis cinerea bei Sonnenblumen (Agarplattentest)
- Septoria petroselini bei Petersilie (direkte mikroskopische Analyse auf Vorhandensein von Perithecien des Erregers)
- Verschiedene samenbürtige Schadpilze (B. cinerea, Colletotrichum lini, Alternaria linicola) bei Lein (Agarplattentest)
- Streifenkrankheit (Pyrenophora graminea) bei Gerste (Filterpapiermethode kombiniert mit Fluoreszenztest)
- Gerstenhartbrand (Ustilago hordei)
Substrate
- Nachweis des Kartoffelkrebserregers (Synchytrium endobioticum) aus Bodenproben mittels eines Nasssiebverfahrens
- Nachweis von Oomyceten (Phytophthora spp.; Pythium spp.) mittels eines Köderverfahrens
Gebühren
- Mykologische Untersuchung Pflanzen, Saatgut (Ausnahmen s.u.) und Substrate je Probe: 49,50 Euro
- Untersuchung auf Brandsporen inkl. Artendifferenzierung: 37,50 Euro
- Untersuchung auf Gerstenflugbrand: 98,50 Euro
Informationen zu Untersuchungen in der Nematologie: Methoden und Gebühren
Generelle Informationen zu nematologischen Untersuchungen
Weiterführende Informationen zu pflanzenparasitären im Gartenbau finden Sie unter folgendem Link: ![]()
Qualitätsmanagement
Vorgehensweise bei nematologischen Untersuchungen
Anleitung zur Probenahme von Privatproben zur Untersuchung auf Nematoden
Nematologische Untersuchungsmethoden
Gebühren für Untersuchungen in der Nematologie
- Die Gebühren werden pro Probe erhoben
- Zystennematoden und Pathotypenfeststellung nach dem Biotestverfahren: 3,00 Euro
- Zystennematoden nach dem Fenwick-Verfahren: 7,00 Euro
- Bestimmung von Gattungen freilebender und gallenbildender Nematoden bei Pflanzen, Boden und Samen: 25,00 Euro
- Molekularbiologische Artbestimmung von Nematodengattungen: 25,00 Euro



