Schaderreger-Nachweis mit der Polymerase-Kettenreaktion (PCR)
Die Polymerase-Kettenreakion (Polymerase chain reaction, PCR) ist eine molekularbiologische Technik, die seit ihrer Erfindung durch den US-Amerikaner Kary B. Mullis im Jahr 1983 in immer mehr Bereiche der Grundlagen- und angewandten Forschung in der Molekularbiologie, Biochemie und Medizin Einzug gehalten hat.
Auch in der Diagnostik von Pflanzenkrankheiten wird die PCR in zunehmendem Maße eingesetzt.
Vorteile der PCR
- hohe Sensitivität
- hohe Spezifität
- Schnelligkeit: die Ergebnisse in spätestens 1 bis 1,5 Tagen vor
Die PCR wurde in der Pathogendiagnostik der LfL etabliert, um die Nachweissicherheit zu verbessern und „diagnostische Lücken“ zu schließen. Es wurden Testverfahren erarbeitet, die besonders geeignet sind für Serienuntersuchungen, die in der Routine leicht und schnell durchführbar sind und trotzdem sichere Resultate liefern.
Einsatzgebiete
Die PCR kommt derzeit vor allem beim Nachweis von Quarantäneschaderregern zum Einsatz, bei dem eine besonders hohe diagnostische Sicherheit gefordert ist. Aber auch beim Nachweis von Bakterien, Pilzen, Viren, Viroiden und Phytoplasmen, die mit herkömmlichen Methoden nicht oder nicht zuverlässig Einsatz erfasst werden können, kommt dei PCR zur Anwendung. Darüber hinaus wird die PCR zur Überprüfung und Abklärung von nicht eindeutigen Ergebnissen, die mit anderen Verfahren gewonnen wurden, herangezogen.
Die PCR kommt derzeit vor allem beim Nachweis von Quarantäneschaderregern zum Einsatz, bei dem eine besonders hohe diagnostische Sicherheit gefordert ist. Aber auch beim Nachweis von Bakterien, Pilzen, Viren, Viroiden und Phytoplasmen, die mit herkömmlichen Methoden nicht oder nicht zuverlässig Einsatz erfasst werden können, kommt dei PCR zur Anwendung. Darüber hinaus wird die PCR zur Überprüfung und Abklärung von nicht eindeutigen Ergebnissen, die mit anderen Verfahren gewonnen wurden, herangezogen.
Ablauf PCR
Vor der PCR wird das Erbmaterial der Schaderreger (in der Regel DNA, bei vielen Pflanzenviren RNA) aus dem Probenmaterial extrahiert.
Bei der PCR werden bestimmte Teile des Erbmaterials des jeweiligen Schaderregers spezifisch vermehrt und angereichert.
Bei der PCR werden bestimmte Teile des Erbmaterials des jeweiligen Schaderregers spezifisch vermehrt und angereichert.
Vervielfätigung Erbinformation
 Zoombild vorhanden
Zoombild vorhanden
Thermocylcer
Die Vervielfätigung der genau definierten Bereiche der Erbinformation des Erregers erfolgt in einem Mikroprozessor-gesteuerten Thermocycler.
Hierzu sind genau festgelegte Temperaturen, die über definierte Zeiträume einzuhalten sind, erforderlich. Der Thermocylcer sorgt dafür, dass die Temperaturvorgaben exakt eingehalten werden .
Hierzu sind genau festgelegte Temperaturen, die über definierte Zeiträume einzuhalten sind, erforderlich. Der Thermocylcer sorgt dafür, dass die Temperaturvorgaben exakt eingehalten werden .
Agarose-Gel
 Zoombild vorhanden
Zoombild vorhanden
Auftrag der Proben auf das Elektrophoresegel
Nach der PCR werden die Proben auf ein Agarose-Gel aufgetragen.
Das Agarose-Gel wird in eine mit Puffer befüllte Elektophoresekammer eingesetzt. Die Proben, die die PCR-Produkte enthalten, werden mit einem Puffer, der einen blauen Farbstoff enthält, vermischt und mit einer Pipette vorsichtig in die vorgefertigten Taschen des Elektrophoresegels pipettiert.
Das Agarose-Gel wird in eine mit Puffer befüllte Elektophoresekammer eingesetzt. Die Proben, die die PCR-Produkte enthalten, werden mit einem Puffer, der einen blauen Farbstoff enthält, vermischt und mit einer Pipette vorsichtig in die vorgefertigten Taschen des Elektrophoresegels pipettiert.
Elektrophoretische Auftrennung
Nach Anschluss der Elektrophoresekammer an das Stromnetz wird die Stromzufuhr angeschaltet. Die negativ geladenen PCR-Produkte werden im Gleichspannungfeld elektrophoretisch aufgetrennt.
Die Auftrennung wird über die Wanderung des bauen Farbstoffs überwacht.
Die Auftrennung wird über die Wanderung des bauen Farbstoffs überwacht.
Durchstrahlung mit UV-Licht
 Zoombild vorhanden
Zoombild vorhanden
Geldokumentationssystem
Nach Beendigung des Elektrophoreselaufs wird das Gel in ein Dunkelkabinett eingebracht und mit UV-Licht durchstrahlt.
Befallsbestimmung
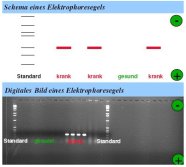
Durch Einlagerung eines im UV-Licht fluoreszierenden Farbstoffs (z. B. Ethidiumbromid) in die PCR-Produkte werden die Erreger-typischen Banden im UV-Licht auf dem Gel sichtbar. Das Gel mit dem resultierenden Bandenmuster wird mit Hilfe einer digitalen Kamera in einem Dunkelkabinett fotografiert.
Zeigt sich die für einen Erreger charakteristische Bande, so ist die dazugehörige Probe mit dem bestimmten Schaderreger befallen. Die Identifizierung des Erregers ist über nachgeschaltete Analyse der PCR-Produkte möglich (Sequenzierung, Restriktionsanalyse).
Zeigt sich die für einen Erreger charakteristische Bande, so ist die dazugehörige Probe mit dem bestimmten Schaderreger befallen. Die Identifizierung des Erregers ist über nachgeschaltete Analyse der PCR-Produkte möglich (Sequenzierung, Restriktionsanalyse).