
Forschungs- und Innovationsprojekt
Entwicklung eines Schnellscreenings auf Pathogene in landwirtschaftlich relevanten Substraten
Es ist nicht auszuschließen, dass in besonderen Fällen in landwirtschaftlichen Substraten (z.B. Wirtschaftdünger), Produkten oder Reststoffen Krankheitserreger enthalten sind, die bei Pflanze, Tier oder Mensch Krankheiten auslösen können. Wenn durch außergewöhnliche Ereignisse Sicherheitssysteme außer Kraft gesetzt sind oder unsachgemäß praktiziert wird, ist eine Verbreitung möglich.
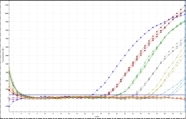 Zoombild vorhanden
Zoombild vorhanden
qPCR-Amplifikationsplots: Verdünnungsreihe eines DNA-Extrakts von einem Krankheitserreger
Verschiedene solcher Krankheitserreger sind nicht in gesetzlichen Vorgaben aufgeführt (z.B. EHEC und ähnliche E. coli, Clostridium botulinum, C. perfringens, C. difficile, Vertreter der Bacillus cereus-Gruppe, MRSA, verschiedene Cryptosporidien oder Mycobakterien). Um einer Verbreitung vorbeugen zu können, müssen seuchenhygienisch relevante Keime schnell, spezifisch und sensitiv nachgewiesen werden können. Nun ist aber die kultivierungsbasierte Analytik teilweise sehr zeitraubend, teilweise bestehen methodische Schwierigkeiten, oder es ist keine Kultivierung möglich.
Moderne molekularbiologische Verfahren wie die quantitative Real-Time PCR (qPCR) eröffnen die Möglichkeit, Proben schnell und hochspezifisch auf die Gegenwart bestimmter Organismen hin zu untersuchen. Bei ihrem Einsatz müsste nur bei einem positiven Nachweis zur Abklärung der Lebensfähigkeit ggf. mit einem kultivierungsbasierten Verfahren weiteruntersucht werden.
Moderne molekularbiologische Verfahren wie die quantitative Real-Time PCR (qPCR) eröffnen die Möglichkeit, Proben schnell und hochspezifisch auf die Gegenwart bestimmter Organismen hin zu untersuchen. Bei ihrem Einsatz müsste nur bei einem positiven Nachweis zur Abklärung der Lebensfähigkeit ggf. mit einem kultivierungsbasierten Verfahren weiteruntersucht werden.
Zielsetzung
- Entwicklung oder Verbesserung qPCR-basierter Schnellscreening-Systeme für landwirtschaftlich relevante Krankheitserreger
- Messungen von Proben aus ausgewählten Biogasanlagen mit der entwickelten qPCR-Analytik
- Evaluierung der Ergebnisse ggf. durch parallele Untersuchung mit einer etablierten konventionellen Analytik
- Entwicklung und Etablierung geeigneter Methoden zur Bestimmung auch lebensfähiger Erreger
Methoden
- qPCR als molekularbiologisches Analysetool zur schnellen und spezifischen Unterscheidung von kontaminiertem und unbelastetem Probenmaterial
- Entwicklung von qPCR-Nachweissystemen für relevante Pathogene in silico
- Evaluierung und Etablierung der qPCR-Nachweissysteme
- Optionaler Einbau eines Voranreicherungsschrittes zur Bestimmung lebensfähiger Krankheitserreger
Zusammenfassung
Es ist ein zentrales Anliegen in der Landwirtschaft, die Sicherheit ihrer Produkte für die Abnehmer und die Produzenten zu gewährleisten. Hierzu dienen Kontrollen u.a. auf das Vorhandensein von lebensfähigen bzw. infektiösen Krankheitserregern in den betrachteten Materialien. Die entsprechende Analytik basiert daher typischerweise auf einer spezifischen Vermehrung der Krankheitserreger durch selektive Kultivierung häufig in mehreren unterschiedlichen Schritten und der anschließenden Untersuchung physiologischer und/oder phänotypischer Eigenschaften erhaltener Reinkulturen.
Stand der Technik
Die spezifische, selektive Kultivierung aus den zu untersuchenden Proben ist nach wie vor der „goldene Standard“ in der Routineanalytik von Krankheitserregern, sie bringt aber auch einige Probleme mit sich: zum einen ist sie ist zumeist sehr zeit- und arbeitsaufwändig. Manche Routinen erfordern Wochen, was z.B. für eine Freigabe verderblicher Ware, insbesondere von Lebensmitteln, viel zu lang ist. Fallweise hatte sich auch gezeigt, dass die vorgeschriebenen Routinen nicht spezifisch genug waren oder dass im schlimmeren Fall die Vermehrung potentieller Krankheitserreger im Nachweisverfahren (teilweise) unterdrückt wurde. Darüber hinaus lassen sich manche Pathogene nicht oder nur sehr schwer kultivieren.
Schnelle Nachweismethoden für die Praxis
Es besteht daher ein dringender Bedarf, schnelle, spezifische und sensitive Nachweisverfahren für praxisrelevante Krankheitserreger zu entwickeln, die auch das Kriterium Lebensfähigkeit bzw. Infektiosität abdecken. Molekularbiologische, insbesondere PCR-basierte Methoden haben in den letzten Jahrzehnten ihren besonderen Wert für eine schnelle, spezifische und sensitive Analytik jeder Art von Organismen bewiesen und haben fallweise auch schon Eingang in die Praxis gefunden. Wenn die Analytik auf DNA abzielt, kann meist nicht zwischen toten bzw. inaktiven und lebenden, aktiven bzw. lebensfähigen oder infektiösen Organismen unterschieden werden. Weiterhin eignet sich die molekularbiologische Analytik typischerweise nur zur Untersuchung kleiner Probenmengen, was bei heterogenem Material meist nicht statistische Erfordernisse erfüllt und zu falsch negativen Ergebnissen führen kann. Diese Anforderungen müssen allerdings Routinen erfüllen, die in der Praxis zum Nachweis von Pathogenen eingesetzt werden sollen.
Einbindung der Molekularbiologie - Nachweis unterschiedlichster Erreger
Im vorliegenden Forschungsvorhaben wurden daher Methoden entwickelt, die diese Kriterien berücksichtigen. Hinsichtlich der untersuchten Materialien lag dabei der Fokus auf Proben aus der Prozesskette landwirtschaftlicher Biogasanlagen, da Biogasanlagen in den letzten Jahren wiederholt der Verbreitung von Krankheitserregern bezichtigt wurden. Hier waren insbesondere krankheitserregende Clostridien wie Clostridium botulinum und pathogene Vertreter von Escherichia coli (EHEC/STEC, EPEC u.a) angesprochen. Für diese, aber auch für Salmonellen, wurden spezifische und sensitive Schnellscreening-Systeme (weiter)entwickelt, evaluiert und etabliert, wobei die molekularbiologische Real-Time qPCR-Analytik zumindest einem Kultivierungsschritt nachgeschaltet wurde. Hierdurch ließ sich zum einen der Nachweis spezifisch von lebensfähigen Einheiten führen, zum anderen gestattete diese Kombination den Einsatz größerer Probenmengen. Weiterhin ließen sich die Erreger mit einem most probable number-Ansatz in der Originalprobe quantifizieren, was zur Definition der Belastung des untersuchten Materials mit dem untersuchten Krankheitserreger und damit zur Einschätzung einer Gefährdung essentiell ist.
Die entwickelte qPCR-Analytik für die toxinogenen Krankheitserreger der Bacillus cereus-Gruppe konnte wegen der verbesserungsbedürftigen Kultivierungsverfahren (noch) nicht zu einer Schnellscreening-Routine mit vorgeschalteter Kultivierung erweitert werden. Allerdings ermöglicht es der Einsatz der qPCR-Analytik bereits in der vorliegenden Form, Zeit einzusparen und den Nachweis spezifischer und sensitiver zu gestalten.
Da die pathogenen Kryptosporidien-Parasiten bislang nicht kultivierbar sind, musste für diese eine andere Strategie zur Etablierung eines Schnellscreening-Systems entwickelt werden. Statt der Fähigkeit zur Vermehrung erwiesen sich die Fähigkeit zur Produktion von Hitzeschockprotein-mRNA oder auch die Excystierbarkeit als geeignete Parameter, die Vitalität und Aktivierbarkeit der Parasiten-Dauerformen durch Induktion mit den entsprechenden Stimuli zu bestimmen. Die Gesamtkonzentration der Oocysten wird dabei auf DNA-Ebene gemessen. Durch die Kombination dieser physiologischen Parameter mit dem entwickelten (RT)qPCR-System lassen sich auch für die schwierige Parasitengruppe der Kryptosporidien Schnellscreening-Systeme erstellen.
Die im vorliegenden Vorhaben entwickelten molekularbiologischen Analyse- und die entsprechenden Schnellscreeningsysteme bildeten die Grundlage zur Durchführung angewandter Forschungsvorhaben und Untersuchungen in der Praxis. Beispielsweise konnte mit diesen die StMELF-Studie N/11/30 „Verhalten von EHEC und krankheitserregenden Clostridien in Biogasanlagen“ erfolgreich bearbeitet werden.
Projektinformation
Kooperation zwischen AQU1c (1; Mikro- und Molekularbiologie) und ILT2a (2; Fermenterbetrieb, Beprobung von Praxisanlagen)
Projektleitung: Dr. Michael Lebuhn (1)
Projektbearbeitung: Bianca Fröschle (1), Elena Madge-Pimentel (1), Rainer Kissel (2), Diana Andrade (2)
Laufzeit: 01.10.2011 – 31.12.2014
Finanzierung: Bayerisches Staatministerium für Ernährung, Landwirtschaft und Forsten
Förderkennzeichen: K/11/08
Kooperation zwischen AQU1c (1; Mikro- und Molekularbiologie) und ILT2a (2; Fermenterbetrieb, Beprobung von Praxisanlagen)
Projektleitung: Dr. Michael Lebuhn (1)
Projektbearbeitung: Bianca Fröschle (1), Elena Madge-Pimentel (1), Rainer Kissel (2), Diana Andrade (2)
Laufzeit: 01.10.2011 – 31.12.2014
Finanzierung: Bayerisches Staatministerium für Ernährung, Landwirtschaft und Forsten
Förderkennzeichen: K/11/08


